Hukum Pertama Termodinamika
Perubahan energi dalam:
Keterangan:
 :Perubahan energi dalam (Joule)
:Perubahan energi dalam (Joule)- U2:Energi dalam pada keadaan akhir (Joule)
- U1:Energi dalam pada keadaan awal (Joule)
- p: Besarnya tekanan (atm)
 : Perubahan volume (liter)
: Perubahan volume (liter)

Penghitungan energi dalam:
- Gas monoatomik:

- Gas diatomik:

Proses-proses termodinamika gas
Proses isobarik
Proses isobarik adalah perubahan keadaan gas pada tekanan tetap.Persamaan keadaan isobarik:

Usaha yang dilakukan pada keadaan isobarik:

Proses isokhorik
Persamaan keadaan isokhorik:

Proses isotermis/isotermik
Proses isotermik adalah perubahan keadaan gas pada suhu tetap.Persamaan keadaan isotermik:

Usaha yang dilakukan pada keadaan isotermik:
- Dari persamaan gas ideal

- Rumus umum usaha yang dilakukan gas:

maka:

karena
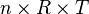 bernilai tetap, maka:
bernilai tetap, maka:
Ingat integral ini!

maka persamaan di atas menjadi
Proses adiabatik
Proses adiabatik adalah perubahan keadaan gas dimana tidak ada kalor yang masuk maupun keluar dari sistem.Persamaan keadaan adiabatik:

Tetapan Laplace:

karena
 , maka persamaan diatas dapat juga ditulis:
, maka persamaan diatas dapat juga ditulis:





![W=n\times R\times T\times [\ln V_{2}-\ln V_{1}]](http://upload.wikimedia.org/math/b/c/0/bc01dcf422d756a7d52153e6bbfc1d08.png)



Tidak ada komentar:
Posting Komentar